2018年11月26日,FDA批准批Vitrakvi(larotrectinib)(代號LOXO-101)震撼上市,Vitrakvi(larotrectinib)是一種口服選擇性原肌球蛋白受體激酶(TRK)抑制劑,用於治療攜帶NTRK融合蛋白的實體瘤。Larotrectinib(LOXO101)今年11月份在世界驚艷亮相,這款針對17種腫瘤有效的新藥終於和廣大癌症患者見面了!同時,這款藥物也有了自己的大名Vitrakvi。
可以說,從2016年12月18日,Loxo Oncology公司的TRK抑制劑LVitrakvi(larotrectinib)(代號LOXO-101)初次在ESMO大會亞洲一期試驗中展示對TRK融合腫瘤顯示的持久抗腫瘤活性,就震驚了腫瘤界,這款不分癌症種類的廣譜抗癌藥開啟了腫瘤治療的新篇章,具有劃時代的意義。
這一藥物的批准,是癌症療法從「基於癌症在體內的起源」轉向「基於腫瘤的遺傳特徵」這一演變過程中的重要里程碑。
我們來回顧一下這款「神藥」從研發到上市的光輝歷程:
2015年9月:授予孤兒藥物資格,用於攜帶NTRK融合蛋白的實體瘤2016年6月:嬰兒纖維肉瘤罕見的兒科疾病指定2016年7月:突破性治療指定「用於治療不能切除或轉移的實體腫瘤,其中NTRK融合蛋白用於需要全身治療的成人和兒科患者,並且在先前治療後進展或者沒有可接受的替代治療。2016年12月18日Loxo Oncology TRK抑制劑Larotrectinib(LOXO-101)在ESMO亞洲第1階段更新中顯示穿越TRK融合癌的持久抗腫瘤活性;2017年2月21日Loxo Oncology宣布完成Larotrectinib NDA主要療效分析的臨床試驗註冊;2017年5月12日FDA宣布授予Larotrectinib孤兒藥物稱號,指定用於治療NTRK融合蛋白的實體腫瘤;2017年6月3日Loxo Oncology突破療法Larotrectinib在美國臨床腫瘤學會提交的TRK融合成人和兒童癌症中顯示76%客觀反應率!2017年12月12日Loxo Oncology更新Larotrectinib兒童臨床試驗數據顯示TRK融合的持續耐受性;2017年12月20日Loxo Oncology開始向美國食品和藥物管理局提交Larotrectinib新藥申請用於治療TRK融合腫瘤;2018年5月:FDA批准用於治療患有NTRK基因融合的局部晚期或轉移性實體瘤的成人和兒童患者的優先審查。2018年11月26號正式在美國上市2018年2月21日Loxo Oncology宣布在新英格蘭醫學雜誌上發表Vitrakvi(larotrectinib)臨床數據:權威發布!針對17種腫瘤的傳奇抗癌藥LOXO-101最新研究數據公布!有效率75%!
其中有一些晚期患者的病灶完全消失了:
我們可以清楚的看到,這位極晚期的肉瘤患者,腫瘤已經快要填滿雙肺,經過LOXO-101治療12周期,腫瘤幾乎完全消失!
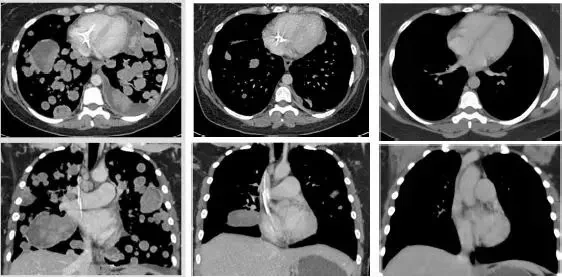
治療前治療3周期第1天治療13周期第1天
2018年3月26日Loxo Oncology完成Larotrectinib治療TRK融合癌新藥申請滾動提交;
2018年3月28日在線的權威腫瘤學雜誌柳葉刀上公布了傳奇抗癌藥larotrectinib(LOXO-101)的最新研究數據!該藥在部分兒童癌症患者達到了93%的治療應答!重磅新數據!針對17種腫瘤的傳奇抗癌藥LOXO-101公布新數據,這次有效率高達93%!
2016年,13歲的Briana Ayala,被發現在她的腹部有一個罕見的腫瘤,包裹在她的主動脈周圍。Briana參加了larotrectinib的1期臨床試驗,幾周之內,她的腹部疼痛和腫脹消失,掃描顯示她的腫瘤顯著縮小。將近兩年後,Briana重返學校!
德克薩斯大學西南分校的研究人員表示,larotrectinib在1期臨床試驗中93%的兒科患者有效。(照片由比爾布蘭森/國家癌症研究所提供)

2018年5月29日FDA接受Larotrectinib新藥申請並授予優先審查;
2018年10月21日Larotrectinib在109個TRK融合癌症患者的擴展數據顯示81%的總體反應率;權威公布!「治癒系」抗癌明星藥LOXO-101新數據:有效率81%!下個月上市(附PDF)
此次批准是基於larotrectinib在多項臨床試驗中的表現。根據今年10月在歐洲腫瘤內科學會(ESMO)年會上公布的最新數據,在55名可以用RECIST標準衡量的TRK融合癌患者中,larotrectinib能夠達到80%的客觀緩解率(ORR)。值得注意的是,larotrectinib在多種癌症類型中的表現都非常一致。
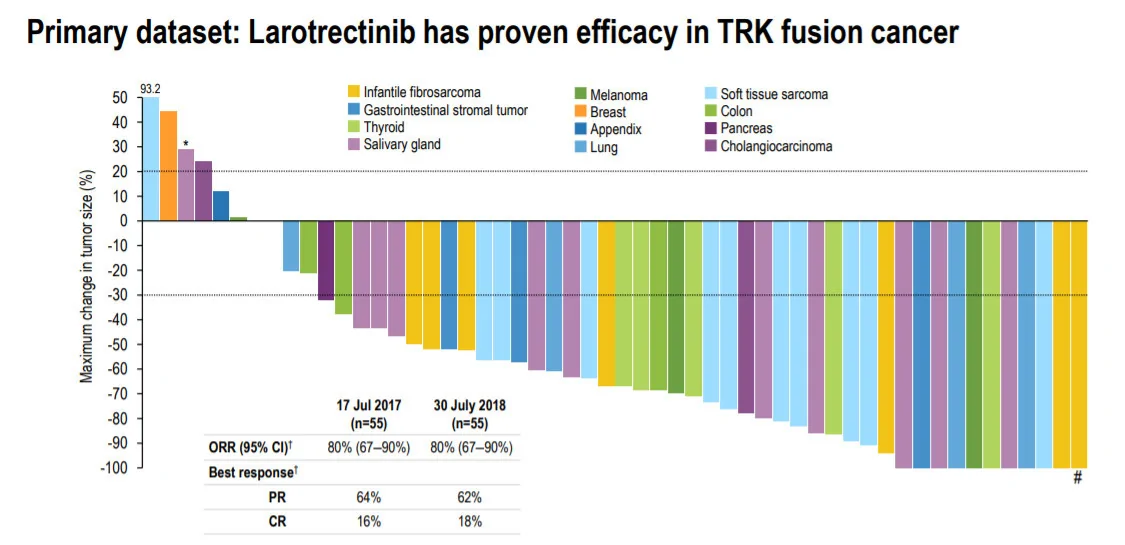
▲Larotrectinib在多種腫瘤類型中都有一致的有效性(圖片來源:Loxo Oncology官網)
這是FDA第二次批准基於不同類型腫瘤的常見生物標誌物的癌症治療,而不是腫瘤起源的身體部位。PD-1的獲批和TRK抑制劑的成功,為不區分腫瘤來源廣譜抗癌藥物快速發展奠定了基礎,讓夢想照進現實!
關於LOXO-101一定要了解的八個問題!
一、哪些患者可以使用Vitrakvi(larotrectinib)?
這個靶向藥不僅療效顯著,還是廣譜抗癌藥物,對很多不同腫瘤都有效!這也這個藥品這麼吸引眼球的原因。
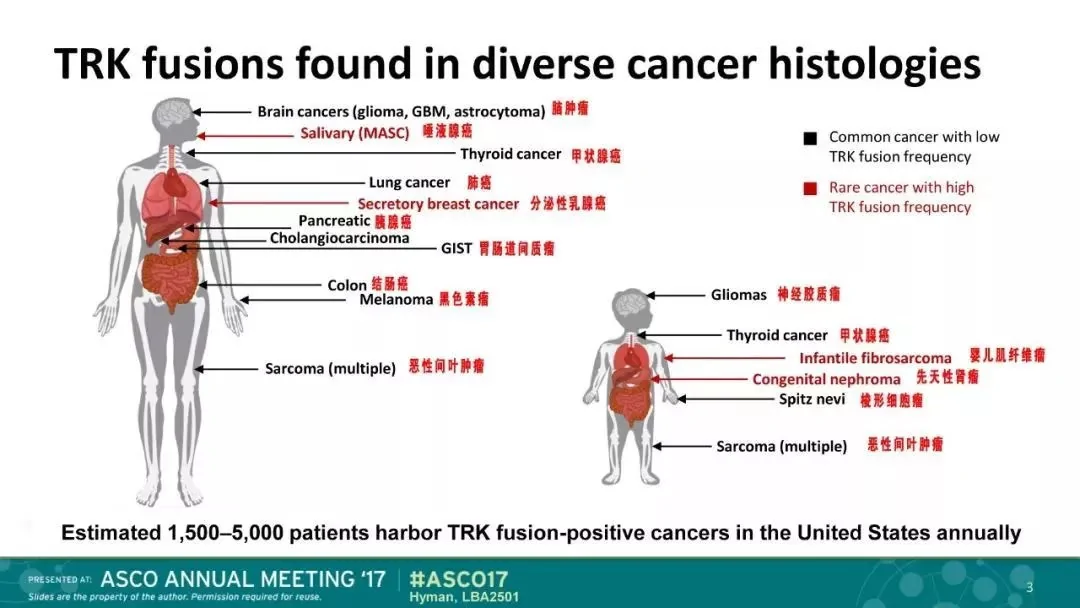
在實驗中,這些患者腫瘤類型包括10種不同的軟組織肉瘤,唾液腺癌,嬰兒纖維肉瘤,甲狀腺,肺,黑素瘤,結腸,胃腸道間質瘤(GIST),乳腺癌,骨肉瘤,膽管癌,原發性未知癌,先天性中胚層腎癌,闌尾和胰腺癌。
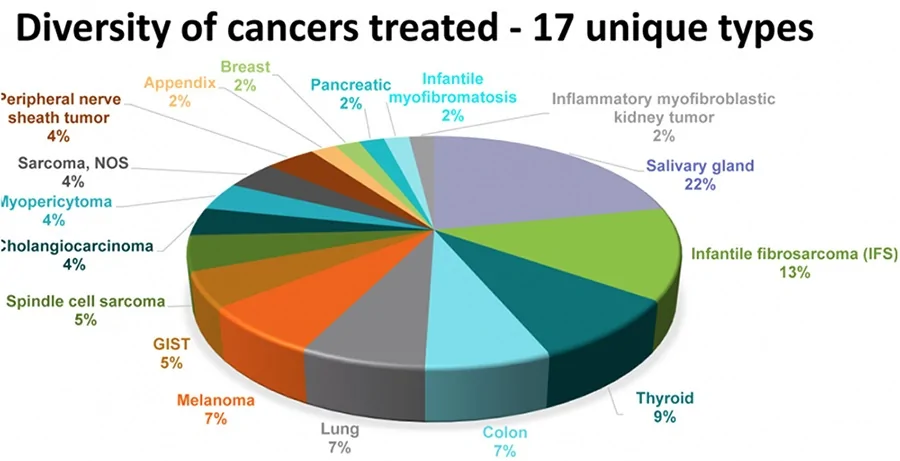
PD1免疫藥物被批准用於MSI-H分子類型的各種腫瘤,成為第一個「廣譜免疫藥物」。LOXO-101很有可能後來者居上,應該會是第一個上市的「廣譜靶向藥物」。
因此,只要你經過基因檢測,存在NTRK1、NTRK2或者NTRK3基因融合,理論上都是適合的!
二、如何檢測NTRK基因?
NTRK基因包含NTRK1、NTRK2和NTRK3,分別負責編碼原肌凝蛋白受體激酶(TRK)家庭蛋白TRKA TRKB和TRKC的合成。神經營養因子與TRK蛋白質結合後可誘導受體二聚體化、磷酸化並激活下游PI3K、RAS/ MAPK/ ERK和PLC-γ的信號級聯通路。越來越多的研究表明,TRK信號通路的改變,包括基因融合、蛋白過度表達或單核苷酸改變,已經被發現是許多腫瘤的致病原因,特別是NTRK基因的融合,是目前其中最明確的致癌原因。
只有敏感和特異的檢測才能可靠地檢測出TRK融合癌基因。新一代測序(NGS)可以提供大量基因的基因體改變的全面視圖,全基因檢測可以較準確的顯示有無NTRK基因融合。螢光原位雜交(FISH)也可用於檢測TRK融合癌,免疫組化(IHC)可用於檢測TRK蛋白的存在。
做過癌症基因體檢測的晚期癌症患者可能會發現他們的腫瘤存在TRK融合,因為這種基因體事件已在許多腫瘤類型中被描述,包括:
急性髓性白血病星形細胞瘤腦低級別膠質瘤乳腺癌結直腸癌先天性中胚層腎瘤胃腸道間質瘤多形性膠質母細胞瘤頭頸部鱗狀細胞癌肝內膽管細胞癌肺癌唾液腺來源的乳腺類似物分泌癌黑色素瘤肉瘤分泌性乳腺癌甲狀腺癌一般檢查融合基因需要使用二代基因檢測技術。而且一定注意是NTRK基因與其他基因融合發生的突變,而不是一個隨便的點突變。
三、你需要了解的NTRK基因知識
NTRK基因包含NTRK1、NTRK2和NTRK3,分別負責編碼原肌凝蛋白受體激酶(TRK)家庭蛋白TRKA TRKB和TRKC的合成。
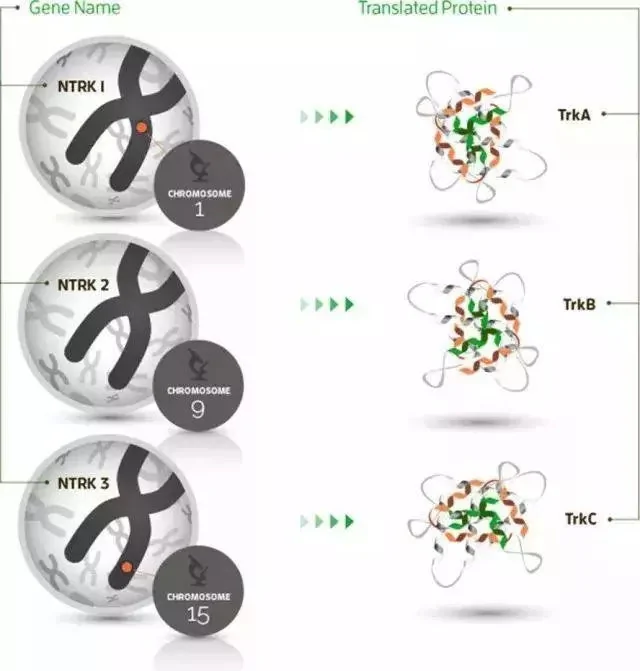
上面是NTRK基因家族,包含NTRK1、NTRK2和NTRK3,這個基因如果和其他的基因發生了融合突變,那麼就導致了異常的活性,驅動了腫瘤的發生。
NTRK在多種腫瘤中都有發現,雖然在常見腫瘤肺癌、結直腸癌中的發病率低於5%,但該通路在各癌種致病中共享。larotrectinib是治療TRK基因突變癌症患者的第一選擇。
四、Vitrakvi(larotrectinib)耐藥後怎麼辦?
面對任何靶向藥物,總會出現的一個問題是:會不會出現耐藥現象?
很不幸,多數患者會,因為腫瘤細胞也在不斷進化。
事實上,已經有一些參與LOXO-101臨床試驗的患者出現了耐藥。
面對耐藥現象,目前只能把希望寄托在是新一代靶向藥物。
可喜的是,現在靶向藥物開發很早期,就會考慮耐藥問題和解決方案。很多時候一代藥物還沒上市,二代藥物就準備好了。科學家經過研究,發現LOXO-101耐藥機理和EGFR情況很像,主要是靶點本身(TRK基因)產生了新的突變,比如TRKA出現G595R突變,或者TRKC出現G623R突變。
2017年11月,拜耳與Loxo腫瘤學開展了一項獨家全球合作,開發LOXO-195,一種新型TRK抑制劑,也是第二代TRK靶向藥物LOXO-195已經出爐。拜耳和Loxo Oncology將共同開發這種產品,專門來對抗LOXO-101耐藥新突變。
關於第二代TRK靶向藥物的論文也在2018年初發表,最初的兩位耐藥患者嘗試新藥後,腫瘤再次快速縮小。比如下面這位,用藥一個月後,耐藥的腫瘤就再次幾乎消失!
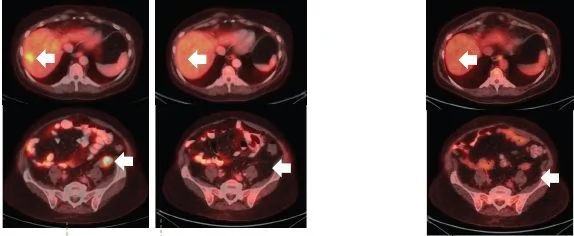
耐藥後使用2代藥一個月後

LOXO-195上個月已經被FDA批准正式開展臨床試驗,耐藥患者有了新希望。
五、Vitrakvi(larotrectinib)副作用有哪些?
對於腫瘤藥物,一個大家很關注的問題是:毒副作用嚴重麼?
藥物的安全性和有效性同樣重要,患者的生活品質和生存時間同樣重要。
LOXO-101展現的療效固然驚艷,但對於熟悉TRK基因,甚至開發過類似藥物的科學家,這個藥在臨床展現出來的副作用十分輕微,這也給大家吃了一個定心丸。
Vitrakvi(larotrectinib)表現出來的副作用十分輕微,主要包括:
大多數患者(93%)發生1級或2級不良反應(AE)。沒有治療相關4級AE,最常見的治療相關3級AE包括:ALT或AST上升(5%),貧血(2%),中性粒細胞計數減少(2%),噁心(2%)和頭暈(2%)。
無論歸因如何,最常見的3級AE(≥5%)為貧血(11%),ALT或AST升高(7%),中性粒細胞計數減少(7%)和體重增加(7%)。
這很可能不是純粹的運氣,因在開發LOXO-101過程中,科學家就針對性地做了大量優化,希望保持對腫瘤療效的同時,減少對神經的毒副作用。比如,他們讓LOXO-101通過血腦屏障的能力減弱,這樣對大腦影響小一些。
到底是優化起了主要作用,還是人和動物模型有本質區別,現在很難說清楚。
重要的是,現在LOXO-101看起來是個有效而且安全的好藥!
六、如何使用Vitrakvi(larotrectinib)?劑量和方法
FDA首次批准日期:2018年11月26日
品牌名稱:Vitrakvi
通用名稱:larotrectinib
劑型:膠囊和口服液
公司:Loxo Oncology,Inc。
治療:TRK融合癌症
LOXO-101:實驗中有液體和膠囊規格和形式;25mg和100mg膠囊也可供兒科患者使用。
劑量:成年人:Larotrectinib對成年人的劑量是100mg,每天兩次!;兒童按年齡和體重使用劑量。
七、國內患者如何接受Vitrakvi(larotrectinib)治療
由於這款「抗癌神藥」剛剛在美國上市,所以目前市場很難買到,不過Medtrip公司的工作人員已經跟美國藥廠聯繫,會第一時間公布藥品的價格和市場信息!
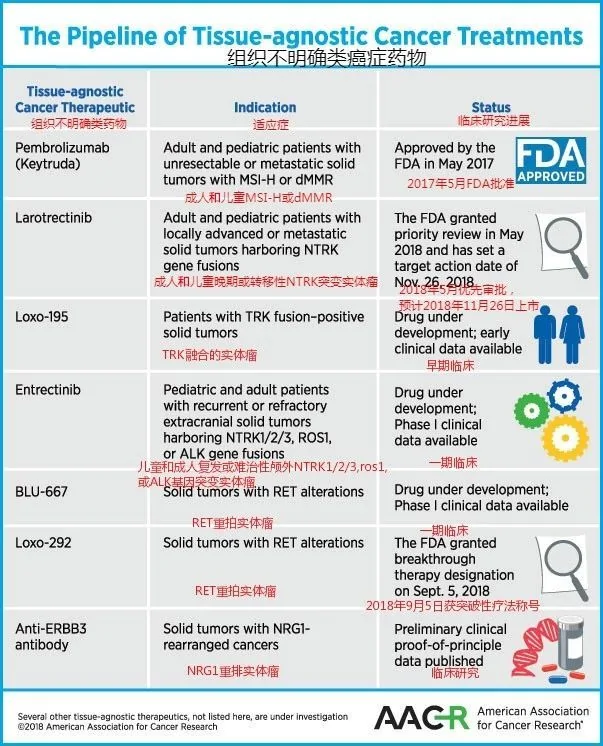
八、類似的不區分癌症種類的廣譜抗癌藥還有哪些?
以下是美國癌症研究協會列出的除keytruda外,6種值得期待的不區分組織來源的重磅抗癌藥物及研發進展,詳情點擊:美國癌症研究協會公布六種值得期待的癌症重磅新藥!
夢想終將照進現實!
Larotrectinib的批准反映了使用生物標誌物指導藥物研發和靶向遞送藥物領域的重大進展。越來越多的醫生將有能力讓合適的患者在正確的時間獲得匹配藥物的治療!