要點:
中國首個XBB疫苗最早於2023年5月17日宣布批准進行臨床試驗,至批准上市僅22天。
獲批新聞中提及的對各變異株中和抗體滴度高、對XBB有效性93%等,均無可核實的文獻報導。從批准臨床試驗至批准僅間隔22天來看,幾乎不可能在臨床試驗中獲得任何上述數據
該疫苗突變株版本無法查到正式發表的臨床試驗論文,原始株疫苗僅一二期臨床試驗發表一篇論文。參考該論文,該疫苗誘導抗體水平與中國最早的新冠重組蛋白疫苗類似
XBB疫苗如今描述的佐劑與以往原始株一二期臨床試驗中描述的佐劑不同,如屬實應歸屬於完全不同的疫苗,安全性等無法參考過往原始株疫苗數據。
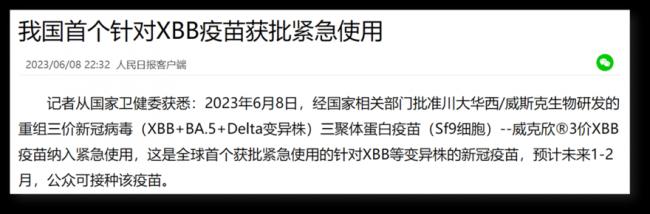
6月8號,全世界第一個XBB疫苗獲批。
經常有人問我XX疫苗怎麼樣。如果這裡的XX是國產疫苗,特別是2022年底一次批准的那一撥多到連名字都已經記不住的疫苗,我一般都只會說能找到的信息比較少。
不信的話你可以自己去找一下。那些疫苗臨床試驗的論文,審核時的有效性、安全性數據分析,上市後到現在的安全性跟蹤,保守的說,屬於隱藏比較深,不太好找到;不保守的說,有的疫苗就是根本找不到。
任何一個疫苗,我們只能根據能找到的信息去核實,去分析。那這次批准的XBB疫苗我們能找到什麼信息呢?除了6月8號獲批的信息,之前的新聞是5月17號獲批進入臨床試驗:
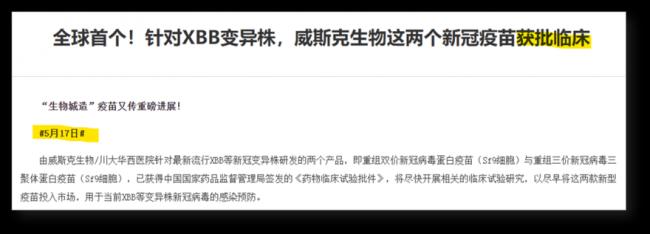
5月17號還是全球首個進入臨床試驗的XBB疫苗,6月8號搖身一變就成了全球首個獲得(緊急使用)批准的XBB疫苗。注意,都是2023年。
5月17號到6月8號,中間有幾天呢?喜歡動手的可以自己掰手指頭數,兩隻手一起用只要掰兩輪多一點就行了,22天。喜歡動嘴的,可以問問Siri,再不放心,能問問google、百度,要趕時髦,還能問問ChatGPT、文心一龍。應該都會告訴你是22天。
22天,應該創了世界紀錄。如果臨床試驗包括了基礎免疫,採用新冠疫苗里較常見的間隔28天打兩針,那麼都來不及讓受試者打上第二針疫苗。
當然,現在絕大多數人都完成了基礎免疫,因此,獲批臨床試驗可能只是做增強針這一針的試驗。對的,就是這個獲批臨床試驗的事兒,都沒有信息顯示具體是什麼類型的臨床試驗,保密程度之高,令人佩服。
我也去看了一下,全球最早進入臨床試驗的新冠疫苗,Moderna的mRNA疫苗,給一期臨床試驗招募的45人打完第一針,是2020年的3月16日到2020年的4月14日:

用了29天。所以,我也不太確定批准進行臨床試驗22天後,能夠招募到多少人完成接種,完成接種後能跟蹤多久。但據報導,已經有臨床試驗數據顯示接種這款疫苗14天後,針對XBB株系的保護效力達到了93.23%。

獲批臨床試驗只有22天,能做出有效性數據,這都不是世界記錄,是世界奇蹟了。不過既然獲批臨床才22天,而有效性跟蹤是接種14天後,那麼就是跟蹤了第15天到22天,頂多7天的有效性?淘寶退貨期限都不止7天吧?以前說多快好省地建設社會主義,這款XBB疫苗至少把「快」和「省」給滿足了。
挺有意思的是,這個XBB疫苗在獲批臨床時就說針對各種變異株都能誘導出很高的中和抗體,也不知道是從誰身上測的抗體:

如今獲批後的新聞直接把對一票變異株有較高中和抗體的內容複製黏貼了一下,只是前面加上「臨床數據顯示」:

只是,什麼水平算高水平?高考還得有一本線、二本線呢,這抗體高水平是啥?抗體中的985,211?又是多少人以及接種多少天后顯示出的高水平呢?
甭管多高的水平,這個Sf9細胞生產的重組蛋白疫苗,我在pubmed上只找到了一篇臨床試驗論文,還是原始株版本的一二期臨床試驗結果:

根據這篇論文,該疫苗的免疫原性和中國最早上市的重組蛋白疫苗差不多,優勢在於採用了更短的接種間隔,如果同樣以三針做基礎免疫可以在一個月內完成(另一個需兩個月):

而且和中國最早批准的重組蛋白疫苗智飛類似,這種Sf細胞里生產的疫苗,基礎免疫用兩針的效果遠遠不如用三針。一期試驗部分,每隔14天打一針的三針組,與隔28天打了兩針的比,同是成年人高劑量組,同樣接種完最後一針28天後測針對原始株的中和抗體滴度,三針組是102.9,兩針組只有2.3。
二期試驗兩針組改成了隔21天打第二針,但高劑量組中和抗體滴度還是只有3.6,遠低於三針組的102.6。兩針組抗體轉陽率也低,結合抗體轉陽率只有69%,中和抗體轉陽率僅49%。
打三針才能誘導出顯著的中和抗體,意味著這個疫苗從技術平台上來說免疫原性不高。論文披露的一些信息也能在原理上做解釋,例如,該疫苗是採用S蛋白的RBD部分做抗原,這與國內最早批准的重組蛋白智飛類似,無非是智飛用CHO細胞生產,該疫苗用Sf細胞生產。目前看來,RBD短抗原的設計,免疫原性不如全長S蛋白是普遍規律,如BioNTech用同一個mRNA疫苗平台做過這兩種設計,最後全長S蛋白無論安全性還是免疫原性都顯著勝出。
另外從新聞報導看,該疫苗和智飛一樣是採用多聚體穩定抗原,也都使用了氫氧化鋁這一免疫原性不強的傳統佐劑。因此,表現類似符合預期。
這種情況下,沒有什麼強有力的數據,突然把這個疫苗說得特別有效,也蠻搞笑的。畢竟,後來一些研究顯示滅活疫苗基礎上混打智飛,免疫反應沒比滅活疫苗同源加強高多少。技術平台決定的免疫原性強弱,不是簡單換個抗原就能改變的。否則把滅活疫苗做成XBB版本,還能吊打mRNA疫苗或是用高效佐劑的重組蛋白疫苗不成?
當然,也有可能當下獲批的XBB疫苗已經徹底改了技術。這倒真有跡可循,如今網上報導該疫苗都稱是基於角鯊烯的水包油乳液佐劑,後者應是和AS03、MF59等類似的佐劑(這兩個都用於一些流感疫苗)。不過那樣的話,就成了完全不同的疫苗技術平台,豈非一篇相關論文都沒有了?
如今新冠不是乙類乙管了嗎?根據一些專家們的說法,新冠和感冒差不多,二陽大部分都很輕微等等。既如此,又為什麼繼續用緊急使用授權去批准新冠疫苗呢?緊急使用授權難道不該是緊急狀態下才需要的嗎?
話說回來,批准進行臨床試驗22天就給予緊急使用授權,感覺真的很緊急,大概是類似外星人入侵般火燒眉毛似的緊急。可據報導,這個獲得緊急使用授權的XBB疫苗要1-2個月後才能讓公眾接種。所以,到底是十萬火急,還是不急呢?
反正吧,22天能從批准臨床試驗變成批准上市,算是創了世界紀錄。也不知這個記錄還有沒有可能被打破,畢竟要更快,大概只能是藥企去向藥監局申請開展臨床試驗,藥監局回復,做毛個試驗,立刻上市,趕緊賺錢去。
咦,等等,好像中成藥就……呃,那22天還真不是記錄。清肺排毒湯劑從發明人將處方公布在朋友圈的2020年1月22日到獲得衛健委推薦的2月6號,僅僅隔了15天。看來,讓國產疫苗趕上博大精深的中成藥,藥企和藥監局還得再加把勁啊。
(註:本文牆內網際網路已經被刪除,本文經由「自由微信」平台獲取。)