《我不是藥神》預告視頻截圖
近期熱映的電影《我不是藥神》,很可能是今年最有價值的中國影片。劇情改編自真實事件:徐崢飾演的保健品店主在一群癌症患者的懇求下,成了某種印度產「救命藥」的總代理商,由此捲入生活和法律的漩渦中。
「救命藥」需要代購,已經成了中國重病患者無奈的選擇。從印度、土耳其、孟加拉、以色列購買的仿製藥,正源源不斷流入中國。
同一種藥品,國內「正版」原研藥的價格,常常是印度仿製藥價格的十倍以上。新聞報導稱,一家印度代購商月流水可以達到700萬元人民幣。
仿製藥,為什麼印度行,中國不行?很多人將此歸咎於專利法和加入WTO導致的醫藥專利壁壘。
但事實上,這並非主要原因。真正的問題在於,在中國開發仿製藥,從頭到尾都舉步維艱。
仿製藥,專利壁壘不是事
專利壁壘的確廣泛存在於製藥行業。比如《我不是藥神》中化名「格列寧」的格列衛,是白血病人們的救命藥,自誕生之日起就自帶專利。

格列衛(網絡圖片)
格列衛是一種直接推動了人類進步的藥物。它可能是人類歷史上第一種真正的「靶向藥物」。
從發現靶點到2001年獲批上市,格列衛的「出生」整整耗費了五十年,製藥企業諾華投資超過50億美元,直接成就了5位美國科學院院士,還催生了兩項足以獲得諾獎的重大發現。
格列衛這樣的研發周期和投入,如果沒有專利,估計就再也沒有企業願意生產了。所以,它的價格也非常驚人。
2015年,瑞士產的原版格列衛,100mg*60片一盒定價23500元,根據不同的適應症,夠用兩周至兩個月不等。在中國,由於獨特的關稅、定價和銷售制度,它的價格更加驚人。即便是在鄰國印度,原廠格列衛的價格也在一萬人民幣左右。
不過對印度人而言,原版藥價格高昂並不十分要緊,因為印度實行了一套獨特的制度來保證仿製藥的生產,使得印度成為世界公認的仿製藥第一大國。仿製藥不是「假藥」,它是「仿製」其他專利藥進行研發和生產的正規藥物。
印度低藥價不僅造福本國人民,也造福了難以負擔高藥價的外國人,印度仿製藥出口已逐步產業化。
一提到「為什麼中國仿製藥不行」,很多分析就將專利壁壘當作問題的關鍵,搬出印度曾經長期對外國藥品專利的不支持,以及對國際「藥品專利強制許可」的執行力度。
所謂「藥品專利強制許可」,簡單來講,就是當重大公共健康危機發生——比如說傳染病、發病率高的重大疾病,而該國又沒有能力生產「救命藥」時,就可以通過一系列法律框架和談判,強行取得專利。
但很少有人注意到的是,印度為仿製藥提供的法律制度性支持,中國法律制度並非沒有提供。
和印度一樣,中國也經歷過長期沒有專利相關法律法規的年代,以及有專利法但幾乎沒有執行的年代。1985年第一版專利法根本沒有保護藥品。直到1992年,為了入世談判,中國出台了一系列過渡性法規。2001年加入世貿組織後,中國才有了規範的藥品專利法規。
「強制許可」也有法規支持。早在2006年1月,中國就通過了《涉及公共健康問題的專利實施強制許可辦法》。2015年,衛計委又出台了《關於印發中國癌症防治三年行動計劃(2015-2017年)的通知》,其中提到:

按理說,中國可以擁有跟印度一樣強大的「藥品專利強制許可」談判能力。不過,由於各方利益難以平衡,這項規定在中國《專利法》頒布30年以來,一次都沒有被實踐過。
連在2005年禽流感肆虐的時期,中國也沒有批准廣州白雲山對「救命藥」達菲的強制許可請求,而是通過談判,讓羅氏把達菲的生產授權給了其他兩家企業。
事實上,在專利制度方面,中國的專利法和寬鬆的專利管理已經盡力了。就在今年,國務院還出台了「20號意見」,放寬了專利限制,鼓勵強制許可。
想要做仿製藥,專利甚至可以完全不是問題——最近的十年剛好是仿製藥的黃金時間,因為「專利斷崖」來了。
藥品專利的保護也有一定期限,一般是6年。2013-2020年,全球每年專利到期品種平均超過200個,其中不乏明星品種。2014年,全球有326個原研藥的專利到期,都可以合法仿製。
因此,中國難以造出廉價的仿製藥給患者使用,並不能怪到專利制度頭上。雖然中國化學藥品批號95%以上都給了仿製藥,但從品類、療效到價格,中國的仿製藥都奇怪地毫無優勢可言。
層層掣肘的中國仿製藥行業
在中國做新藥難,做仿製藥也難。做藥難,首先就難在藥企能力的不足。
為了說明這一點,首先要從製藥的生產流程說起。
製藥非一日之功,化工原料要經過一系列複雜的處理,這個過程中的產物叫醫藥中間體。最終得到的有效成分,稱為原料藥,也就是藥品中的有效成分。有了有效成分,我們還要把它提純,加入藥品輔料,做成真正的膠囊、藥片、注射劑。這是需要一整個產業鏈才能完成的事。

如果你要做一種仿製藥,除了把「正版」研究透,還要尋找合適的中間體、原料藥,以及藥品輔料了。而這些東西,大多數是由全國四千餘家中小型藥企生產的。
中國大多數原料藥和製劑藥企都是中小企業,「百強」的市場集中度大概只有50%左右,遠低於全球範圍內的80%左右。其中,很多企業連《藥品生產質量管理規範》(GMP質量標準)和環保排污的要求都達不到。
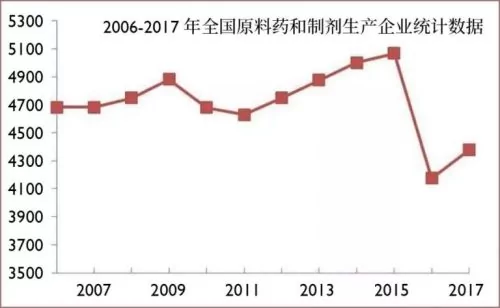
中國原料藥和製劑藥企數量統計。2016年GMP質量體系「實裝上線」、環保嚴查運動之後,這些企業的數量一下銳減將近一千家。
企業規模上不去,獲得融資能力和研發能力也上不去。至今中國生產和出口量最大的原料藥,還是低端老四樣:維生素,食品添加劑、甜味劑,抗生素。這些「大路貨」占據產能,同時帶來原料藥生產利潤低下、高端品種依賴進口的問題,形成惡性循環。
藥品輔料的問題更是一言難盡。
相比於美國FDA要求仿製藥的輔料達到和藥品相同的標準,中國的藥品輔料生產和使用基本上沒有規範。雖然早在2006年中國就出台過《藥用輔料生產質量管理規範》(藥輔GMP標準),但這個標準是非強制的,疏於管理、無人監督。

藥品輔料,就是澱粉、膜衣、崩解劑、黏合劑、膠囊殼等等,幫助你更好地咽藥和發揮藥物作用的成分。
別小瞧藥品輔料的作用。一顆好的膠囊能夠決定一粒藥是在口腔、胃裡還是腸道里準確地散開,進而直接影響仿製藥的藥效。一顆糟糕的膠囊則可能來自鉻超標的工業明膠。

2014年中國發生毒膠囊事件,約9000萬粒有害膠囊流入市場。
當原料齊備,你的仿製藥終於可以研發製造了。這時候你需要解決的核心難題就來了:怎麼確定仿製藥和原來的藥物效果一樣?
仿製藥可不是「假藥」,做仿製藥和開發新藥一樣,都需要規範的研發、生產、審評。光把藥品的「物質」照樣造出來還不夠,還需要保證「一致性」——藥理上一樣,對人體的作用也一樣。
然而,就在幾年前,中國仿製藥的一致性評價標準還是一片混亂。
比如,要審評「一致性」,首先得確定用來參照的原版藥物是什麼,專業名詞叫「參比製劑」。要仿製阿莫西林,就得從全世界那麼多品牌的阿莫西林里選擇一種,才能有標準。
中國報備參比製劑的正式制度長期缺席。即便報備了,也有可能不能獲得原研藥企業的支持,甚至因為原版藥退市完全買不到藥。國內還出現過某品種的參比製劑公布太晚,導致43家企業集體「抄錯對象」的慘案。

文件出來後,43家企業發現自己集體跑錯了路。
因為審評制度和標準上的缺失,長期以來,國產仿製藥安全而低效,參比製劑混亂、晶形和劑型隨便、輔料業餘、療效無把關,除了肯定含有宣稱的成分,其他一切都是不確定的。
2008年後,中國多次抽查了當時市面上合格的國產仿製藥,與原研藥進行「體外溶出曲線」的對比,發現幾乎所有的國產仿製藥都和原研藥相去甚遠。
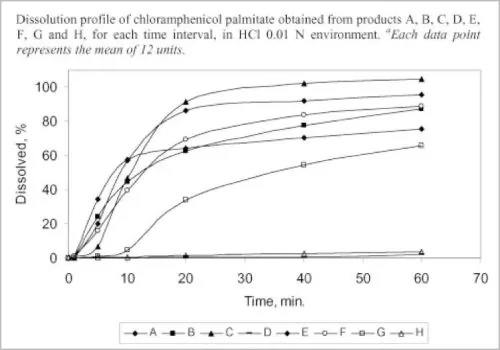
體外溶出曲線研究,可以在體外模擬人體對藥物的溶解吸收情況。如果仿製藥和原研藥的溶出曲線差異太大,則療效非常可疑。
好在,2013年,中國終於出台了仿製藥一致性評價制度。溶出曲線已經納入了評價「藥學一致性」的重要指標。雖然技術標準極不完整,但總歸是一大進步。
但別以為這就完了,因為後面還有更棘手的「生物等效性」的檢驗難題。
要審評仿製藥的「生物等效性」,就很可能需要通過臨床試驗這一大難關。
由於相關規定,中國的臨床實驗只能在獲得批准的、數量有限、排期緊缺的「臨床試驗基地」進行。這些基地大多同時又是三甲醫院,仿製藥難以搞出科研成果,這些基地的冷淡態度也就可想而知。
而最難的還在後面:
2006年國家藥監總局局長鄭筱萸因巨額受賄被執行死刑後的十年裡,中國的醫藥審批一直謹慎行事,壓量、拖期、能不批就不批。結果十年後,忽然到來的醫藥風口讓中國的監管部門措手不及。

鄭筱萸巨貪數百萬,批准多種「假藥」上市。瀋陽一家殺鼠滅蟲劑廠商將其姓名註冊成了品牌,表示對貪官的痛恨。
2015年,中國負責藥品審評的官員一共只有一百多人,需要面對一萬多件新藥、仿製藥、醫療器械和進口藥物的臨床和上市申請,以及數千件補充申請和備案。
監管者的解決辦法是:想方設法把你們打回去。
於是就有了2015年「731公告」中著名的積壓與拖延條款,以專利期屆滿時間設卡,將很多已經排到了審評門口的仿製藥直接趕回家:

好消息是,在不斷的降積壓手段之後,我們藥品註冊申請的積壓項目,終於從2015年高峰時的近22000件,降到了2016年底的8863件,並在之後的一年中繼續下降。
好了,費盡千辛萬苦,你的仿製藥終於通過了審評。
據估算,一個仿製藥要在中國走通這個正規流程,至少需要500萬到1000萬人民幣——這還不算各級尋租、積壓拖延的成本。
由於做藥難,中國的仿製藥整體上並不便宜。
比如易瑞沙(吉非替尼,Iressa),由阿斯利康研發,是用於非小細胞肺癌的靶向藥物。2016年國家藥品價格談判之後,原版250mg*10片/10天量的零售價是2358元。
易瑞沙在中國的專利已經在2016年4月到期,隨後大批國資企業開始仿製。2017年2月,齊魯藥業的首仿品種「伊瑞可」獲批上市,10天量的價格是1850元。
如果去代購印度版的仿製易瑞沙,10天量約合211元。當然,它在中國算「假藥」。
用上救命藥,依然不容易
如前所述,救命藥即便在中國成功仿製,也很難人人買得起,一時半會指望不上。不過,中國人還有一根救命稻草:國家藥品價格談判,即由政府出面,向原產藥企壓低售價。
截至去年,累計談判成功藥物共有39種,基本上降價幅度都在「打五折」以上。
以最成功的替諾福韋(Viread)為例。這是一種由吉利德開發的B肝一線用藥,進入中國時的價格是1500元300mg*30片(一月量)。2016年,替諾福韋的專利有效性被幾家中國企業起訴。經過幾輪複雜的拉鋸,法院判決替諾福韋所有專利無效,大批國產仿製藥擠進戰場。
同年,替諾福韋參與了國家價格談判,直接降價67%,變成499元一個月,僅略高於印度版本。
不過,國家藥品價格談判的滯後性,使印度仿製藥依然具有強大競爭力——現在,國內的患者已經開始從印度、寮國和孟加拉代購副作用更小的「替諾福韋二代」TAF了,代購價大概只有400元一個月。
而且,即便原版藥品在國家談判後降價了,或者有廠家真的生產出了良心價的國產仿製藥,你也不一定能用得上。
這是因為,雖然中國的醫保藥品目錄是通用的,由衛生部門確定,但醫院採購、使用管理和核算報銷政策是分省的,並且涉及到當地人社部門。多數一般藥品只能靠藥企反覆公關,一個省一個省地拿下,或者拿不下。
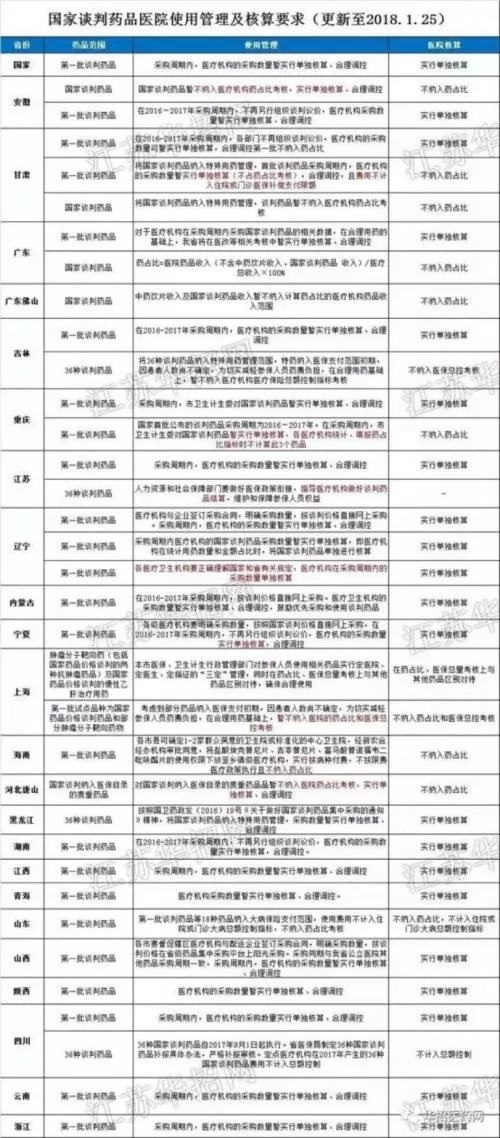
行業網站「華招醫藥網」總結的各省對國家談判藥品的態度。
而且,國家醫保藥品目錄平均五年才更新一次。
雖然形勢在逐漸好轉,但在未來的幾年中,國產平價救命藥仍將是可望不可及。中國患者代購印度「假藥」的困局,仍將持續下去。
不要忘了,依據檢方的不起訴決定書,「藥神」的原型陸勇之所以被法律寬恕,首要因素是因為其替病友代購的行為全部是無償幫助,未收取任何額外費用,因此未被認定為銷售行為。

陸勇,《我不是藥神》主人公的原型,因幫助自己和其他患者代購印度仿製藥,成為新聞人物。
如果病友信賴的代購者不再是陸勇這樣完全無償的完美被告人,所購藥品依然被中國法律定義為「假藥」,那麼代購者仍必然構成刑法上的銷售假藥罪而身陷囹圄。
這是一部電影難以解決的問題。